![]()
![]()
![]()
a
xb
x /Kk
xC
x × 102a x
b
x /Kk
xC
x × 102a x
b
x /KC
x × 1021
0,74
-122,83
0,23
0,013
-
-
-
-
1,54
-279,81
0,567
2
2,04
-472,63
0,10
0,781
2,27
-519,84
-0,43
1,896
2,38
-598,73
2,269
3
3,93
-869,37
-1,23
1,687
4,82
-1122,06
-2,43
4,104
3,87
-1165,83
9,396
4
3,34
-843,98
-1,40
4,530
4,22
-1115,28
-2,33
5,162
3,68
-1220,40
8,200
5
3,53
-831,88
-1,70
0,928
4,26
-1078,03
-3,55
1,717
4,25
-1360,24
3,537
6
2,52
-539,42
-0,75
1,113
3,30
-805,52
-3,48
1,651
3,00
-1022,83
4,435
7
3,82
-966,66
-1,51
1,453
5,19
-1439,46
-4,71
2,499
5,22
-1765,72
4,186
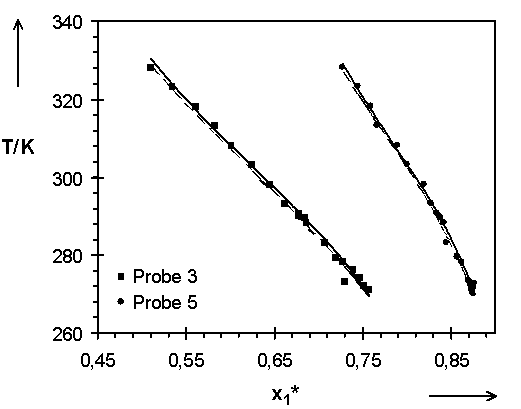 Abb.(8.1): Darstellung der berechneten Quellungskurven mit den Parametern der Tab.(7.1) und (7.6b) für die Netzwerke 3 und 5.
¾
Gele als ternäre bzw. - - - binäre Systeme behandelt
Die für die Berechnung der Quellungskurven verwendeten Parameter sind der Tab.(8.1) zu entnehmen. Sowohl der Entropie- als auch der Enthalpieterm des FHSS-Wechselwirkungsparameters haben in der Beschreibung der Gele als ternäre Systeme kleinere Beträge, als in der Behandlung als binäre Systeme. Eine Betrachtung des Netzwerkparameters Cx zeigt den genau entgegengesetzten Effekt. Die Werte für c
x werden durch die Berücksichtigung des copolymeren Charakters der Netzwerke, ausgenommen Netzwerk 4, größer. Der Anstieg ist bei den Netzwerken 1 und 2 mit einer Größenordnung am stärksten ausgeprägt.
Tab.(8.1): Gegenüberstellung der Parameter, die unter Verwendung des Ansatzes
Abb.(8.1): Darstellung der berechneten Quellungskurven mit den Parametern der Tab.(7.1) und (7.6b) für die Netzwerke 3 und 5.
¾
Gele als ternäre bzw. - - - binäre Systeme behandelt
Die für die Berechnung der Quellungskurven verwendeten Parameter sind der Tab.(8.1) zu entnehmen. Sowohl der Entropie- als auch der Enthalpieterm des FHSS-Wechselwirkungsparameters haben in der Beschreibung der Gele als ternäre Systeme kleinere Beträge, als in der Behandlung als binäre Systeme. Eine Betrachtung des Netzwerkparameters Cx zeigt den genau entgegengesetzten Effekt. Die Werte für c
x werden durch die Berücksichtigung des copolymeren Charakters der Netzwerke, ausgenommen Netzwerk 4, größer. Der Anstieg ist bei den Netzwerken 1 und 2 mit einer Größenordnung am stärksten ausgeprägt.
Tab.(8.1): Gegenüberstellung der Parameter, die unter Verwendung des Ansatzes 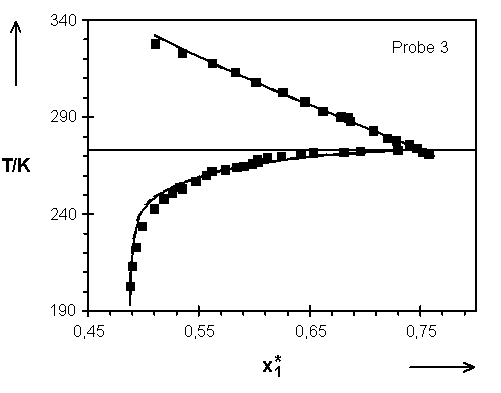 Abb.(8.2): Darstellung der berechneten Quellungskurven mit den Parametern der Tab.(8.2) für das Netzwerk 3.
¾
Gel als ternäres bzw. - - - binäres System behandelt
Tab.(8.2): Gegenüberstellung der Parameter, die für den Bereich 203 K bis 328 K durch die Behandlung der Gele a) als binäre bzw. b) als ternäre Systeme berechnet worden sind.
Abb.(8.2): Darstellung der berechneten Quellungskurven mit den Parametern der Tab.(8.2) für das Netzwerk 3.
¾
Gel als ternäres bzw. - - - binäres System behandelt
Tab.(8.2): Gegenüberstellung der Parameter, die für den Bereich 203 K bis 328 K durch die Behandlung der Gele a) als binäre bzw. b) als ternäre Systeme berechnet worden sind.
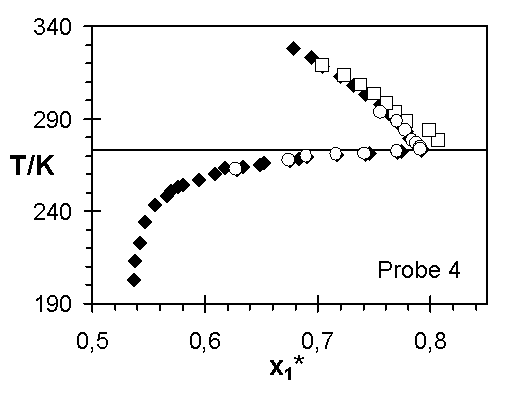
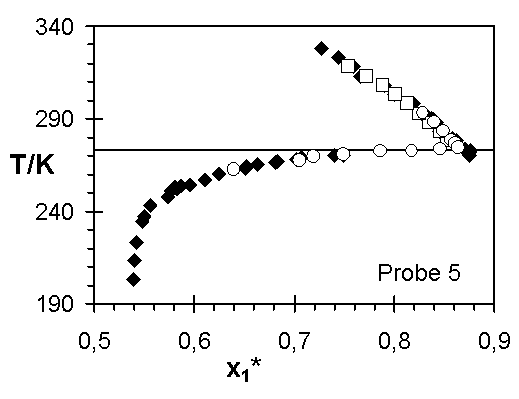
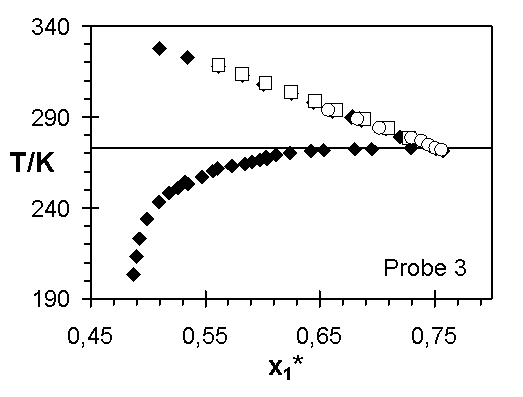
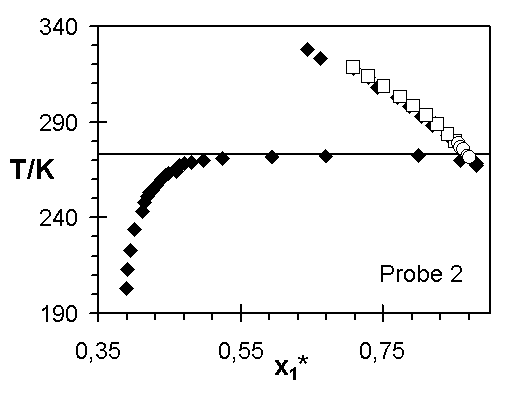
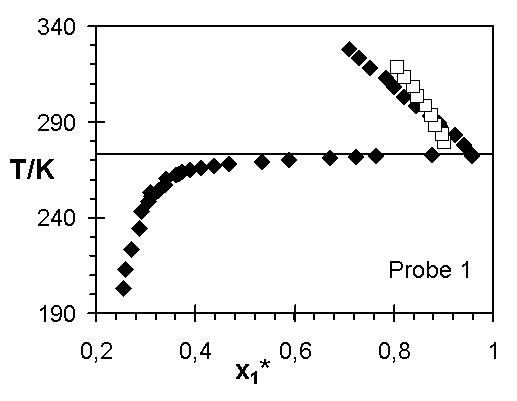
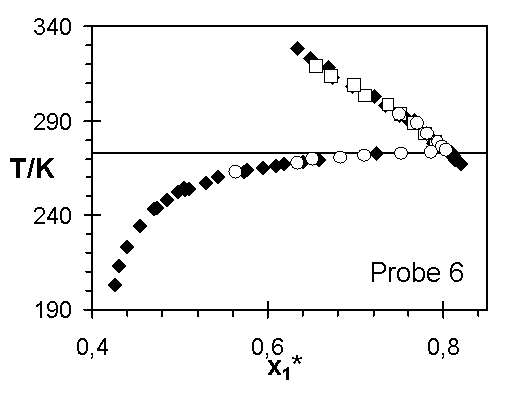
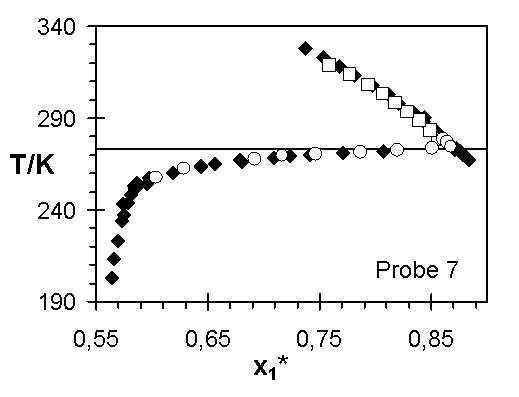 Abb.(8.3): Zusammenfassung der experimentellen Wertepaare von Steinbrecht ¨
, Hladik ™
und dieser Arbeit ¿
für die Netzwerke 1 bis 7.
Die Abweichungen zwischen den Ergebnissen von Steinbrecht und den experimentellen Quellungskurven dieser Arbeit für das Netzwerk 1 kann verschiedene Ursachen haben. In den einzelnen Experimenten sind nicht dieselben Netzwerkscheibchen untersucht worden. Ist z. B. die Vernetzungsdichte in diesem Netzwerk vom Ort abhängig, das heißt weist die Netzwerkprobe Inhomogenitäten auf, können unterschiedliche Stücke des Netzwerks unterschiedliche Quellungsgrade bei gleicher Temperatur aufweisen. Sowohl die Vernetzungsdichte, über die Größe 1/zx, als auch der Quellungsgrad, über den Grundmolenbruch des Wassers, verändern den Wert des Zählers der Steigung der Quellungskurve. Zeigen diese beiden Größen für unterschiedliche Proben eines Netzwerks verschiedene Werte, werden unterschiedliche Verläufe der Quellungskurve bestimmt.
Tab.(8.2): Zusammenfassung der für die verschiedenen exp. Wertepaare berechneten Parametersätze für die Quellung im flüssigen Wasser.
Abb.(8.3): Zusammenfassung der experimentellen Wertepaare von Steinbrecht ¨
, Hladik ™
und dieser Arbeit ¿
für die Netzwerke 1 bis 7.
Die Abweichungen zwischen den Ergebnissen von Steinbrecht und den experimentellen Quellungskurven dieser Arbeit für das Netzwerk 1 kann verschiedene Ursachen haben. In den einzelnen Experimenten sind nicht dieselben Netzwerkscheibchen untersucht worden. Ist z. B. die Vernetzungsdichte in diesem Netzwerk vom Ort abhängig, das heißt weist die Netzwerkprobe Inhomogenitäten auf, können unterschiedliche Stücke des Netzwerks unterschiedliche Quellungsgrade bei gleicher Temperatur aufweisen. Sowohl die Vernetzungsdichte, über die Größe 1/zx, als auch der Quellungsgrad, über den Grundmolenbruch des Wassers, verändern den Wert des Zählers der Steigung der Quellungskurve. Zeigen diese beiden Größen für unterschiedliche Proben eines Netzwerks verschiedene Werte, werden unterschiedliche Verläufe der Quellungskurve bestimmt.
Tab.(8.2): Zusammenfassung der für die verschiedenen exp. Wertepaare berechneten Parametersätze für die Quellung im flüssigen Wasser.
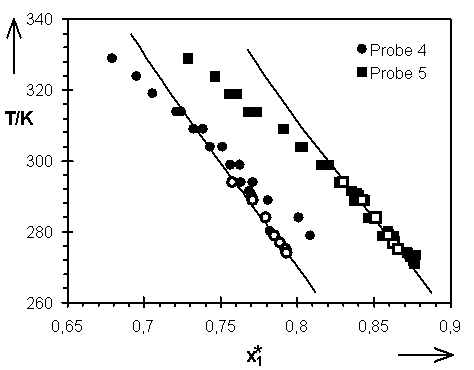 Abb.(8.4): Darstellung der mit den Parametern für die experimentellen Daten von Hladik berechneten Quellungskurven und ihre Lage zu der Kombination aller Wertepaare. Die Wertepaare von Hladik sind durch die Symbole o
und o
gekennzeichnet.
Bei den Proben 5 bis 7 ergeben sich aus den Wertepaaren von Steinbrecht für alle drei bestimmten Parametern wesentlich größere Werte, als für die Ergebnisse dieser Arbeit. Auch diese Differenzen zwischen den Ergebnissen der unterschiedlichen Autoren können auf die unterschiedlich großen Temperaturbereiche, in denen die Experimente durchgeführt worden sind, zurückgeführt werden. Von Steinbrecht ist der Bereich 279,15 K £
T £
318,15 K untersucht worden. Die Ergebnisse dieser Arbeit überstreichen hingegen das Intervall [267,15 K; 328,15 K], das heißt einen um 20 Grad größeren Bereich. Eine Betrachtung der mit den Parametern für die Daten von Steinbrecht berechneten Quellungskurven, Abb.(8.6) und (8.7), der Netzwerke 5, 6 und 7 zeigt, daß sie zu den höheren und niedrigeren Temperaturen von der "Gesamt-Quellungskurve" abweichen.
Abb.(8.4): Darstellung der mit den Parametern für die experimentellen Daten von Hladik berechneten Quellungskurven und ihre Lage zu der Kombination aller Wertepaare. Die Wertepaare von Hladik sind durch die Symbole o
und o
gekennzeichnet.
Bei den Proben 5 bis 7 ergeben sich aus den Wertepaaren von Steinbrecht für alle drei bestimmten Parametern wesentlich größere Werte, als für die Ergebnisse dieser Arbeit. Auch diese Differenzen zwischen den Ergebnissen der unterschiedlichen Autoren können auf die unterschiedlich großen Temperaturbereiche, in denen die Experimente durchgeführt worden sind, zurückgeführt werden. Von Steinbrecht ist der Bereich 279,15 K £
T £
318,15 K untersucht worden. Die Ergebnisse dieser Arbeit überstreichen hingegen das Intervall [267,15 K; 328,15 K], das heißt einen um 20 Grad größeren Bereich. Eine Betrachtung der mit den Parametern für die Daten von Steinbrecht berechneten Quellungskurven, Abb.(8.6) und (8.7), der Netzwerke 5, 6 und 7 zeigt, daß sie zu den höheren und niedrigeren Temperaturen von der "Gesamt-Quellungskurve" abweichen.
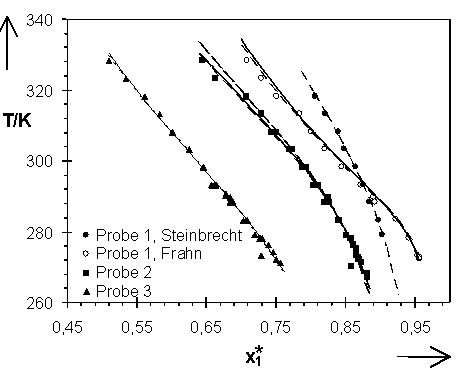 Abb.(8.5): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 1 bis 3. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
Abb.(8.5): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 1 bis 3. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
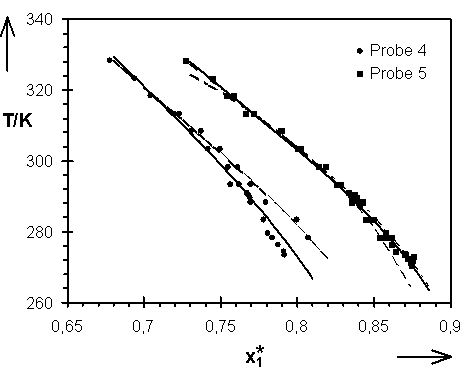 Abb.(8.6): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 4 und 5. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
Abb.(8.6): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 4 und 5. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
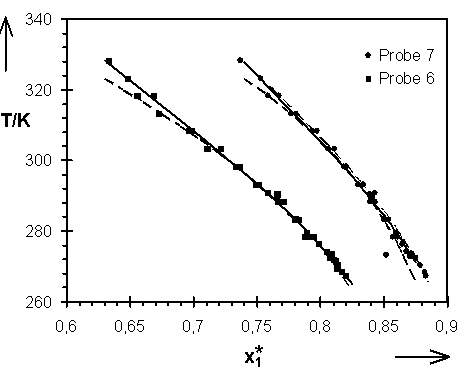 Abb.(8.7): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 6 und 7. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
Die mit den Parametern der Tab. (8.2A) bis (8.2C) berechneten Quellungskurven sind in den Abb.(8.5) bis (8.7) den experimentellen Daten gegenübergestellt. Eine Differenzierung der Quellungskurven, die mit den Parametern der Tab.(8.2A) bzw. (8.2B) berechnet wurden ist praktisch nicht möglich. Beide Parametersätze können als vergleichbar gute Beschreibung der experimentellen Daten angesehen werden. Dieses spiegelt sich auch in den Parametern selbst, die, bis auf die Werte der Probe 6, nur wenig von einander differieren.
Die Kombination von allen zur Verfügung stehenden experimentellen Wertepaaren im Bereich 273 K £
T £
328 K werden hinreichend gut durch die Parametersätze, welche für die Ergebnisse dieser Arbeit berechnet worden sind, beschrieben.
Hladik hat in seinen Experimenten auch Quellungsgrade im kristallinen Wasser für die Netzwerke 4 bis 7 ermittelt. Mit den von ihm im Temperaturbereich 257,65 K bis 293,15 K bestimmten T(
Abb.(8.7): Darstellung der relativen Lage der mit den Parametern der Tab.(8.2A) bis (8.2C) berechneten Quellungskurven zu den exp. Daten der Proben 6 und 7. ¾
Kombination aller Wertepaare; - - - nur Wertepaare von Steinbrecht; - ×
- ×
- nur Wertepaare dieser Arbeit.
Die mit den Parametern der Tab. (8.2A) bis (8.2C) berechneten Quellungskurven sind in den Abb.(8.5) bis (8.7) den experimentellen Daten gegenübergestellt. Eine Differenzierung der Quellungskurven, die mit den Parametern der Tab.(8.2A) bzw. (8.2B) berechnet wurden ist praktisch nicht möglich. Beide Parametersätze können als vergleichbar gute Beschreibung der experimentellen Daten angesehen werden. Dieses spiegelt sich auch in den Parametern selbst, die, bis auf die Werte der Probe 6, nur wenig von einander differieren.
Die Kombination von allen zur Verfügung stehenden experimentellen Wertepaaren im Bereich 273 K £
T £
328 K werden hinreichend gut durch die Parametersätze, welche für die Ergebnisse dieser Arbeit berechnet worden sind, beschrieben.
Hladik hat in seinen Experimenten auch Quellungsgrade im kristallinen Wasser für die Netzwerke 4 bis 7 ermittelt. Mit den von ihm im Temperaturbereich 257,65 K bis 293,15 K bestimmten T(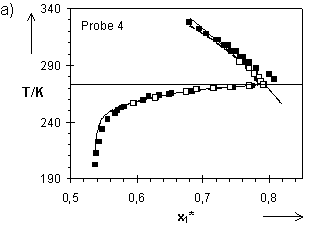
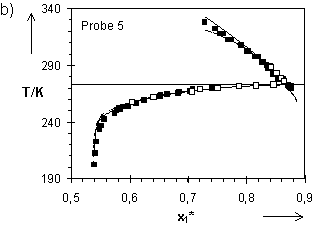
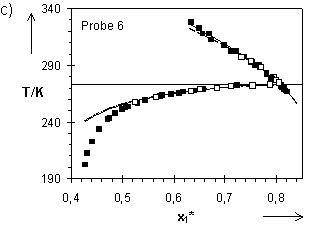
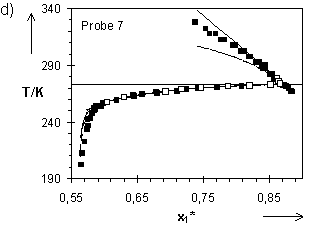
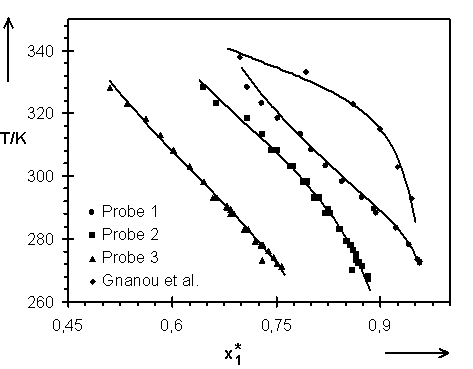 Abb.(8.9): Experimentelle und berechnete Quellungskurven der Netzwerke 1 bis 3 dieser Arbeit sowie eines Netzwerks von Gnanou et al. für T > 273,15 K. Die Parameter für die Netzwerke 1 bis 3 sind Tab.(7.1), die entsprechenden Daten für das Netzwerk von Gnanou der Tab.(8.5b) zu entnehmen.
Eine Betrachtung des Netzwerks 1 und des Polyurethangels von Gnanou hinsichtlich ihrer Zusammensetzung zeigt, daß der Unterschied zwischen diesen beiden Netzwerken auf die Länge der Polymerketten zwischen den Knotenpunkten reduziert werden kann. Das in Gnanous Netzwerk eingebaute Polyethylenglykol hat etwa die doppelte Länge des PEG, welches in Probe 1 vorliegt. Der für Probe 1 berechnete Wert des Netzwerkparameters CX sollte größer sein als der für Gnanous Netzwerk. Dieses wird nicht gefunden. Der Wert von Cx für Probe 1 ist mit Cx = 1,81×
10-4 um eine Größenordnung kleiner als der für Gnanous Probe. Dieses impliziert, daß das Netzwerk 1 eine wesentlich geringere Vernetzungsdichte aufweist, als nach den eingesetzten Konzentrationen der Edukte in der Netzwerksynthese zu erwarten ist. Dieses wird durch den relativ geringen Reaktionsumsatz, der mit Hilfe der Statistik aus den extrahierbaren, löslichen Anteilen dieses Netzwerks in Kapitel 8.1.7 berechnet wird, bestätigt.
Entsprechend der Zusammensetzung der Netzwerke 1, 2 und 3 ist eine Abfolge in den Parametern a
x, b
x und Cx zu erwarten, da sich die Proben nur durch die Länge der Netzwerkketten unterscheiden. Das Netzwerk, welches das PEG mit der niedrigsten molaren Masse (Probe 3) enthält, sollte den größten Netzwerkparameter zeigen bzw. Probe 1 (höchste molare Masse) sollte den kleinsten Cx-Wert aufweisen [120]. Entsprechend sollten die Werte für ax und bx ebenfalls eine Sequenz zeigen. Diese vorausgesagte Abfolge in den Parametern wird sowohl für die Beschreibung der Gele als binäre als auch als ternäre Systeme gefunden.
Eine Betrachtung der Parameter für die Beschreibung der Gele als binäre bzw. ternäre Systeme im gesamten untersuchten Temperaturbereich zeigt, daß auch hier die genannten Abfolgen in den Werten für a
x, b
x, und Cx gefunden werden. Der Wert von kx wird mit steigendem Polymerisationsgrad der Netzwerkketten größer.
Ein Vergleich der experimentellen Quellungskurven im kristallinen Quellmittel mit Ergebnissen anderer Autoren ist nicht möglich. In der Literatur werden keine Untersuchungen bezüglich des Quellverhaltens chemisch vernetzter Polymere bei Temperaturen unterhalb des Schmelzpunktes eines Quellmittels erwähnt.
Abb.(8.9): Experimentelle und berechnete Quellungskurven der Netzwerke 1 bis 3 dieser Arbeit sowie eines Netzwerks von Gnanou et al. für T > 273,15 K. Die Parameter für die Netzwerke 1 bis 3 sind Tab.(7.1), die entsprechenden Daten für das Netzwerk von Gnanou der Tab.(8.5b) zu entnehmen.
Eine Betrachtung des Netzwerks 1 und des Polyurethangels von Gnanou hinsichtlich ihrer Zusammensetzung zeigt, daß der Unterschied zwischen diesen beiden Netzwerken auf die Länge der Polymerketten zwischen den Knotenpunkten reduziert werden kann. Das in Gnanous Netzwerk eingebaute Polyethylenglykol hat etwa die doppelte Länge des PEG, welches in Probe 1 vorliegt. Der für Probe 1 berechnete Wert des Netzwerkparameters CX sollte größer sein als der für Gnanous Netzwerk. Dieses wird nicht gefunden. Der Wert von Cx für Probe 1 ist mit Cx = 1,81×
10-4 um eine Größenordnung kleiner als der für Gnanous Probe. Dieses impliziert, daß das Netzwerk 1 eine wesentlich geringere Vernetzungsdichte aufweist, als nach den eingesetzten Konzentrationen der Edukte in der Netzwerksynthese zu erwarten ist. Dieses wird durch den relativ geringen Reaktionsumsatz, der mit Hilfe der Statistik aus den extrahierbaren, löslichen Anteilen dieses Netzwerks in Kapitel 8.1.7 berechnet wird, bestätigt.
Entsprechend der Zusammensetzung der Netzwerke 1, 2 und 3 ist eine Abfolge in den Parametern a
x, b
x und Cx zu erwarten, da sich die Proben nur durch die Länge der Netzwerkketten unterscheiden. Das Netzwerk, welches das PEG mit der niedrigsten molaren Masse (Probe 3) enthält, sollte den größten Netzwerkparameter zeigen bzw. Probe 1 (höchste molare Masse) sollte den kleinsten Cx-Wert aufweisen [120]. Entsprechend sollten die Werte für ax und bx ebenfalls eine Sequenz zeigen. Diese vorausgesagte Abfolge in den Parametern wird sowohl für die Beschreibung der Gele als binäre als auch als ternäre Systeme gefunden.
Eine Betrachtung der Parameter für die Beschreibung der Gele als binäre bzw. ternäre Systeme im gesamten untersuchten Temperaturbereich zeigt, daß auch hier die genannten Abfolgen in den Werten für a
x, b
x, und Cx gefunden werden. Der Wert von kx wird mit steigendem Polymerisationsgrad der Netzwerkketten größer.
Ein Vergleich der experimentellen Quellungskurven im kristallinen Quellmittel mit Ergebnissen anderer Autoren ist nicht möglich. In der Literatur werden keine Untersuchungen bezüglich des Quellverhaltens chemisch vernetzter Polymere bei Temperaturen unterhalb des Schmelzpunktes eines Quellmittels erwähnt.
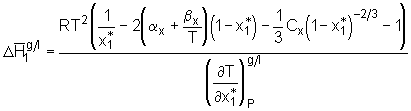 . (8.1)
Die T(
. (8.1)
Die T(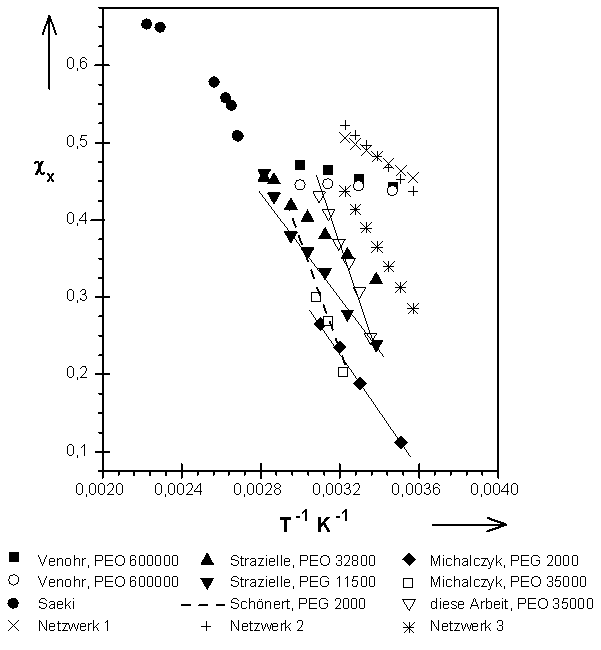 Abb.(8.10): Darstellung der Funktion c
x(1/T) für unterschiedliche PEO- bzw. PEG-Proben bestimmt mit unterschiedlichen Methoden.
Die Ergebnisse zeigen, daß für alle aufgezeigten Beispiele eine lineare Abhängigkeit des Wechselwirkungsparameters von der reziproken Temperatur gefunden wird. Die Steigung dieser c
x(1/T) Geraden sind in allen gezeigten Fällen negativ. Hierbei muß darauf hingewiesen werden, daß die Steigungen der Geraden, normiert über dem jeweiligen Konzentrationsbereich, etwa den gleichen Wert haben, mit leicht abnehmender Tendenz relativ zu den Molmassen der Polymeren. Dieses steht im Einklang mit der State-Equation Theorie von Flory [126-128]. Entsprechend dieser Theorie sollte der Wechselwirkungsparameter mit steigender Konzentration und konstantem Druck sowie konstanter Temperatur größer werden. Dieses wird hauptsächlich durch den Effekt des ausgeschlossenen Volumens hervorgerufen. Zusätzlich scheinen die Beträge der Steigung für die Systeme lineares Polymer/Lösemittel vom Polymerisationsgrad des jeweiligen Polyethylenoxids bzw. -glykols abhängig zu sein. Hierbei ist es allerdings nicht möglich eine Abfolge für die beschriebenen PEG- bzw. PEO-Proben zu definieren.
Generell kann gesagt werden, daß die Zahl und der Typ der Endgruppen einer Polymerkette den Wechselwirkungsparameter beeinflussen. Hierbei gilt: je geringer der Polymerisationsgrad einer Kette, desto mehr Endgruppen von Netzwerkketten sind vorhanden und somit ist auch ihr Einfluß auf den Betrag des c
x-Parameters um so größer. Da in einem Netzwerk die Endgruppen der linearen Polymerketten mit den Knotenpunkten verknüpft sind, ist ein direkter Vergleich zwischen den c
x-Parametern, die für die Systeme vernetztes PEG/Wasser (z. B. Netzwerke 1 bis 3) bzw. freie PEG Kette/Wasser bestimmt worden sind, nicht möglich. Es kann lediglich gesagt werden, daß die Werte für den Parameter b
x, das heißt den Enthalpieterm des FHSS-Wechselwirkungsparameters, welche für die Netzwerke gefunden worden sind, zu den Ergebnissen für die unvernetzten Polymeren passen. In einem Netzwerk beeinflußt anstelle der Endgruppen einer freien Kette, die Art der Fixierung der Enden der Polymerketten innerhalb des Netzwerks den Wechselwirkungsparameter. Außerdem ist es möglich, daß das Wasser, durch die Einschränkung der Wechselwirkungen, bedingt durch sterische Hinderungen, ein schlechteres Lösemittel für die PEG-Ketten der Netzwerke als für freie Polyethylenglykolketten ist.
Abb.(8.10): Darstellung der Funktion c
x(1/T) für unterschiedliche PEO- bzw. PEG-Proben bestimmt mit unterschiedlichen Methoden.
Die Ergebnisse zeigen, daß für alle aufgezeigten Beispiele eine lineare Abhängigkeit des Wechselwirkungsparameters von der reziproken Temperatur gefunden wird. Die Steigung dieser c
x(1/T) Geraden sind in allen gezeigten Fällen negativ. Hierbei muß darauf hingewiesen werden, daß die Steigungen der Geraden, normiert über dem jeweiligen Konzentrationsbereich, etwa den gleichen Wert haben, mit leicht abnehmender Tendenz relativ zu den Molmassen der Polymeren. Dieses steht im Einklang mit der State-Equation Theorie von Flory [126-128]. Entsprechend dieser Theorie sollte der Wechselwirkungsparameter mit steigender Konzentration und konstantem Druck sowie konstanter Temperatur größer werden. Dieses wird hauptsächlich durch den Effekt des ausgeschlossenen Volumens hervorgerufen. Zusätzlich scheinen die Beträge der Steigung für die Systeme lineares Polymer/Lösemittel vom Polymerisationsgrad des jeweiligen Polyethylenoxids bzw. -glykols abhängig zu sein. Hierbei ist es allerdings nicht möglich eine Abfolge für die beschriebenen PEG- bzw. PEO-Proben zu definieren.
Generell kann gesagt werden, daß die Zahl und der Typ der Endgruppen einer Polymerkette den Wechselwirkungsparameter beeinflussen. Hierbei gilt: je geringer der Polymerisationsgrad einer Kette, desto mehr Endgruppen von Netzwerkketten sind vorhanden und somit ist auch ihr Einfluß auf den Betrag des c
x-Parameters um so größer. Da in einem Netzwerk die Endgruppen der linearen Polymerketten mit den Knotenpunkten verknüpft sind, ist ein direkter Vergleich zwischen den c
x-Parametern, die für die Systeme vernetztes PEG/Wasser (z. B. Netzwerke 1 bis 3) bzw. freie PEG Kette/Wasser bestimmt worden sind, nicht möglich. Es kann lediglich gesagt werden, daß die Werte für den Parameter b
x, das heißt den Enthalpieterm des FHSS-Wechselwirkungsparameters, welche für die Netzwerke gefunden worden sind, zu den Ergebnissen für die unvernetzten Polymeren passen. In einem Netzwerk beeinflußt anstelle der Endgruppen einer freien Kette, die Art der Fixierung der Enden der Polymerketten innerhalb des Netzwerks den Wechselwirkungsparameter. Außerdem ist es möglich, daß das Wasser, durch die Einschränkung der Wechselwirkungen, bedingt durch sterische Hinderungen, ein schlechteres Lösemittel für die PEG-Ketten der Netzwerke als für freie Polyethylenglykolketten ist.
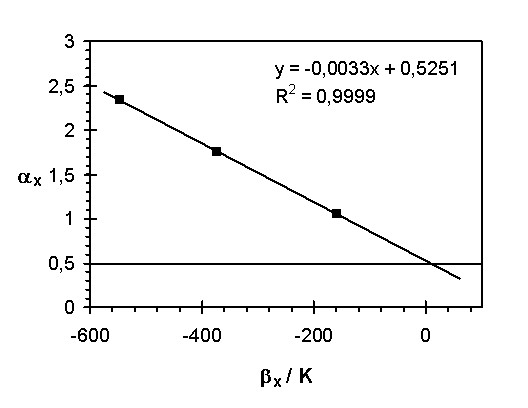 Abb.(8.11): Darstellung der Beziehung zwischen den Parametern a
x und b
x der Netzwerke 1 bis 3. Die Parameter entsprechen den Ergebnissen für die Beschreibung der Gele als binäre Systeme oberhalb 273,15 K.
Abb.(8.11): Darstellung der Beziehung zwischen den Parametern a
x und b
x der Netzwerke 1 bis 3. Die Parameter entsprechen den Ergebnissen für die Beschreibung der Gele als binäre Systeme oberhalb 273,15 K.
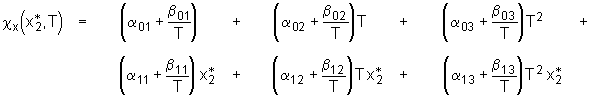 (8.9)
Durch eine Temperatur- und Konzentrationsabhängigkeit der Größen a
x und b
x ergeben sich demnach mindestens 12 Parameter mit denen die Abweichung eines Polymersystems von einem ideal-athermischen beschrieben werden kann. Übertragung dieses Ausdrucks auf die Bedeutung des Parameters kx in dem in dieser Arbeit gewählten Ausdruck für den FHSS-Wechselwirkungsparameter führt zu
(8.9)
Durch eine Temperatur- und Konzentrationsabhängigkeit der Größen a
x und b
x ergeben sich demnach mindestens 12 Parameter mit denen die Abweichung eines Polymersystems von einem ideal-athermischen beschrieben werden kann. Übertragung dieses Ausdrucks auf die Bedeutung des Parameters kx in dem in dieser Arbeit gewählten Ausdruck für den FHSS-Wechselwirkungsparameter führt zu
 Abb.(8.12): Gemeinsame Darstellung der Quellungskurven im flüssigen Wasser bestimmt in den "reinen" Quellungsexperimenten sowie den Entquellungsexperimenten. Die Ergebnisse der Entquellungsversuche sind durch die Symbole o
, ¡
und D
gekennzeichnet.
In der zweiten Möglichkeit der Auswertung der Entquellungsexperimente werden der Netzwerkparameter sowie der Enthalpie- und Entropieterm des FHSS-Wechselwirkungsparameters durch nicht-lineare-Regressionsanalysen bestimmt. Die so berechneten Netzwerkparameter weisen keine Temperaturabhängigkeit auf. Die Cx-Werte der Netzwerke 1 und 7 haben aber auch bei dieser Auswertung ein negatives Vorzeichen, vgl. Tab.(7.10). In der folgenden Diskussion werden diese beiden Netzwerke nicht weiter berücksichtigt.
In Abb.(7.17) ist gezeigt worden, daß bei den Netzwerken 2 bis 6 mit den berechneten Parametern Cx, a
x und b
x eine recht gute Beschreibung der Quellungs- und Entquellungskurve gegeben ist. Auffällig ist, daß die beiden für ein Netzwerk berechneten Kurven nicht, wie zu erwarten, parallel verlaufen. Vielmehr weist bei allen Netzwerken die Quellungskurve in reinem Wasser eine kleinere Steigung auf, als die Kurve für die Quellung in der PEO-Lösung. Dieses Verhalten ist in Abb.(8.13) nochmals für die Netzwerke 4 und 5 dargestellt.
Abb.(8.12): Gemeinsame Darstellung der Quellungskurven im flüssigen Wasser bestimmt in den "reinen" Quellungsexperimenten sowie den Entquellungsexperimenten. Die Ergebnisse der Entquellungsversuche sind durch die Symbole o
, ¡
und D
gekennzeichnet.
In der zweiten Möglichkeit der Auswertung der Entquellungsexperimente werden der Netzwerkparameter sowie der Enthalpie- und Entropieterm des FHSS-Wechselwirkungsparameters durch nicht-lineare-Regressionsanalysen bestimmt. Die so berechneten Netzwerkparameter weisen keine Temperaturabhängigkeit auf. Die Cx-Werte der Netzwerke 1 und 7 haben aber auch bei dieser Auswertung ein negatives Vorzeichen, vgl. Tab.(7.10). In der folgenden Diskussion werden diese beiden Netzwerke nicht weiter berücksichtigt.
In Abb.(7.17) ist gezeigt worden, daß bei den Netzwerken 2 bis 6 mit den berechneten Parametern Cx, a
x und b
x eine recht gute Beschreibung der Quellungs- und Entquellungskurve gegeben ist. Auffällig ist, daß die beiden für ein Netzwerk berechneten Kurven nicht, wie zu erwarten, parallel verlaufen. Vielmehr weist bei allen Netzwerken die Quellungskurve in reinem Wasser eine kleinere Steigung auf, als die Kurve für die Quellung in der PEO-Lösung. Dieses Verhalten ist in Abb.(8.13) nochmals für die Netzwerke 4 und 5 dargestellt.
 Abb.(8.13): Darstellung der mit den Parametern der Tab.(7.10) berechneten Quellungs- bzw. Entquellungskurven. Die Ergebnisse der Entquellungsversuche sind durch die Symbole o
, ¡
gekennzeichnet.
Tab.(8.12): Ergebnisse der Regressionsanalysen für die Netzwerke 2 bis 6 aus a) den Entquellungsexperimenten bzw. b) den reinen Quellungsversuchen. Außerdem sind die cx-Werte für eine mittlere Temperatur verzeichnet.
Abb.(8.13): Darstellung der mit den Parametern der Tab.(7.10) berechneten Quellungs- bzw. Entquellungskurven. Die Ergebnisse der Entquellungsversuche sind durch die Symbole o
, ¡
gekennzeichnet.
Tab.(8.12): Ergebnisse der Regressionsanalysen für die Netzwerke 2 bis 6 aus a) den Entquellungsexperimenten bzw. b) den reinen Quellungsversuchen. Außerdem sind die cx-Werte für eine mittlere Temperatur verzeichnet.
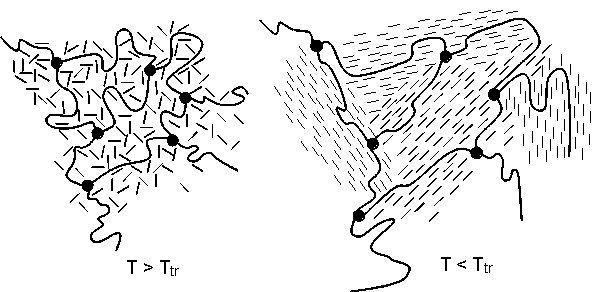 Abb.(8.14): Schematische Darstellung der Aufweitung eines Netzwerks durch eine partielle Mitorientierung der Netzwerkketten, liegen im Netzwerk flüssig-kristalline Bereiche vor.
Molekular betrachtet führt die Mitorientierung der Netzwerkketten zu einer Streckung der Ketten, wodurch sich die Knotenpunktabstände vergrößern. Im Netzwerk besteht dann die Tendenz, weiteres Quellmittel aufzunehmen. Eine solche Situation ist in Abb.(8.14) schematisch dargestellt. Im linken Bild liegt das Quellmittel innerhalb des Netzwerks im isotropen Zustand vor. Wird die Temperatur des Phasenübergangs unterschritten, orientiert sich das Quellmittel in kleinen Bereichen und verursacht neben der Mitorientierung der Netzwerkketten, eine Aufweitung der Netzwerkstruktur. Die Netzwerkmaschen werden vergrößert, so daß mehr Quellmittel aufgenommen werden kann. Außerdem bedingt die Orientierung der flüssig-kristallinen Quellmittel eine Dichteerhöhung des Quellmittels. Es passen mehr Quellmittelmoleküle in die "Hohlräume" des Netzwerks, woraus ebenfalls eine Erhöhung des Quellungsgrades resultiert.
Abb.(8.14): Schematische Darstellung der Aufweitung eines Netzwerks durch eine partielle Mitorientierung der Netzwerkketten, liegen im Netzwerk flüssig-kristalline Bereiche vor.
Molekular betrachtet führt die Mitorientierung der Netzwerkketten zu einer Streckung der Ketten, wodurch sich die Knotenpunktabstände vergrößern. Im Netzwerk besteht dann die Tendenz, weiteres Quellmittel aufzunehmen. Eine solche Situation ist in Abb.(8.14) schematisch dargestellt. Im linken Bild liegt das Quellmittel innerhalb des Netzwerks im isotropen Zustand vor. Wird die Temperatur des Phasenübergangs unterschritten, orientiert sich das Quellmittel in kleinen Bereichen und verursacht neben der Mitorientierung der Netzwerkketten, eine Aufweitung der Netzwerkstruktur. Die Netzwerkmaschen werden vergrößert, so daß mehr Quellmittel aufgenommen werden kann. Außerdem bedingt die Orientierung der flüssig-kristallinen Quellmittel eine Dichteerhöhung des Quellmittels. Es passen mehr Quellmittelmoleküle in die "Hohlräume" des Netzwerks, woraus ebenfalls eine Erhöhung des Quellungsgrades resultiert.
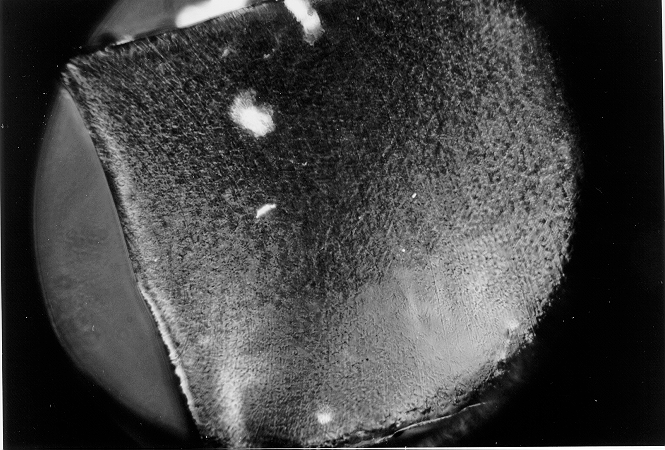 Abb.(8.15): Polarisationsmikroskopische Aufnahme der Probe 8 bei 40°C.
Abb.(8.15): Polarisationsmikroskopische Aufnahme der Probe 8 bei 40°C.
 Abb.(8.16): Polarisationsmikroskopische Aufnahme der Probe 8 bei 30°C.
Zur Überprüfung dieses Erklärungsansatzes sind Experimente mit einem Polarisationsmikroskop, das über einen Heiztisch verfügt, durchgeführt worden. Hierzu wurde zunächst das Quellungsgleichgewicht des untersuchten Netzwerks in dem jeweiligen mesogenen Quellmittel bei einer Temperatur oberhalb der Phasenumwandlungstemperatur eingestellt. Von der voll gequollenen Netzwerkprobe wurde mit einem Skalpell eine möglichst dünne Scheibe abgeschnitten und auf einen Probenträger gebracht. Die Abb.(8.15) und (8.16) zeigen Photographien des Netzwerks 8, gequollen in Octadecansäuremethylester, die mit dem Polarisationsmikroskop aufgenommen worden sind. Bei Abb.(8.15) liegt die Temperatur mit 40°C knapp oberhalb der Umwandlungstemperatur smektisch - isotrop. Das Gel hebt sich klar gegen den schwarzen Untergrund ab. Die großen hellen Flecken müssen auf Verunreinigungen zurückgeführt werden.
Das zweite Photo, Abb.(8.16), ist bei 30°C und somit im smektischen Existenzbereich des Quellmittels aufgenommen worden. Das Gel hebt sich wiederum klar gegen den Hintergrund ab, es sind aber auch deutlich kleine, weiße Punkte zu erkennen, die über die gesamte Probe verteilt sind. Sie deuten darauf hin, daß das Quellmittel innerhalb des Gels als smektische Phase vorliegt.
In einer thermodynamischen Beschreibung des Systems muß also eine flüssig-kristalline Umwandlung des Quellmittels innerhalb des Gels berücksichtigt werden. Für die Steigung der Quellungskurve unterhalb der Umwandlungstemperatur des flüssig-kristallinen Quellmittels ergibt sich unter der Berücksichtigung, daß die Gelphase im flüssig-kristallinen Zustand vorliegt [69]
Abb.(8.16): Polarisationsmikroskopische Aufnahme der Probe 8 bei 30°C.
Zur Überprüfung dieses Erklärungsansatzes sind Experimente mit einem Polarisationsmikroskop, das über einen Heiztisch verfügt, durchgeführt worden. Hierzu wurde zunächst das Quellungsgleichgewicht des untersuchten Netzwerks in dem jeweiligen mesogenen Quellmittel bei einer Temperatur oberhalb der Phasenumwandlungstemperatur eingestellt. Von der voll gequollenen Netzwerkprobe wurde mit einem Skalpell eine möglichst dünne Scheibe abgeschnitten und auf einen Probenträger gebracht. Die Abb.(8.15) und (8.16) zeigen Photographien des Netzwerks 8, gequollen in Octadecansäuremethylester, die mit dem Polarisationsmikroskop aufgenommen worden sind. Bei Abb.(8.15) liegt die Temperatur mit 40°C knapp oberhalb der Umwandlungstemperatur smektisch - isotrop. Das Gel hebt sich klar gegen den schwarzen Untergrund ab. Die großen hellen Flecken müssen auf Verunreinigungen zurückgeführt werden.
Das zweite Photo, Abb.(8.16), ist bei 30°C und somit im smektischen Existenzbereich des Quellmittels aufgenommen worden. Das Gel hebt sich wiederum klar gegen den Hintergrund ab, es sind aber auch deutlich kleine, weiße Punkte zu erkennen, die über die gesamte Probe verteilt sind. Sie deuten darauf hin, daß das Quellmittel innerhalb des Gels als smektische Phase vorliegt.
In einer thermodynamischen Beschreibung des Systems muß also eine flüssig-kristalline Umwandlung des Quellmittels innerhalb des Gels berücksichtigt werden. Für die Steigung der Quellungskurve unterhalb der Umwandlungstemperatur des flüssig-kristallinen Quellmittels ergibt sich unter der Berücksichtigung, daß die Gelphase im flüssig-kristallinen Zustand vorliegt [69]
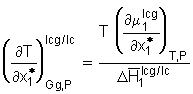 . (8.13)
Hierin stehen die Indizes lcg und lc für flüssig-kristallines Gel bzw. für flüssig-kristallines Quellmittel. Da es sich um stabile Gelphasen handeln sollte, ist der Differentialquotient
. (8.13)
Hierin stehen die Indizes lcg und lc für flüssig-kristallines Gel bzw. für flüssig-kristallines Quellmittel. Da es sich um stabile Gelphasen handeln sollte, ist der Differentialquotient 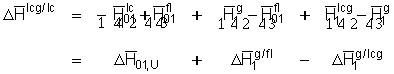 . (8.15)
Der letzte Term dieser Gleichung entspricht der Schmelzwärme der Mischphase Gel/"flüssig-kristallines Gel".
. (8.15)
Der letzte Term dieser Gleichung entspricht der Schmelzwärme der Mischphase Gel/"flüssig-kristallines Gel".